 Chanvre vs cannabis
Chanvre vs cannabis
Le chanvre est une plante herbacée annuelle originaire d'Asie centrale et occidentale.
Le chanvre et le cannabis sont des plantes toutes deux identifiées sur le plan botanique comme Cannabis sativa.
Ces deux formes sont considérées par la majorité des experts comme une seule et même espèce, divisée elle-même en 3 sous-espèces : sativa, indica et ruderalis… reconnues parfois comme des variétés.
D’ailleurs, chanvre et cannabis peuvent parfaitement s’hybrider.
En apparence, le chanvre affiche des caractéristiques typiques avec des feuilles plus longues et fines et des tiges fibreuses, en comparaison avec un plant de cannabis qui peut être assez buissonneux et trapu.
Biologiquement, leur composition diffère notamment au niveau des substances présentes dans les sommités fleuries.
Historiquement, Cannabis sativa a accompagné l’homme et rythmé sa vie depuis la nuit des temps dans presque toutes les civilisations :
- À partir de ses fibres comme matériau pour élaborer des tissus, des cordages, des voilures et des éléments de construction,
- À partir de ses graines comme denrée alimentaire pour les animaux d’élevage et les humains,
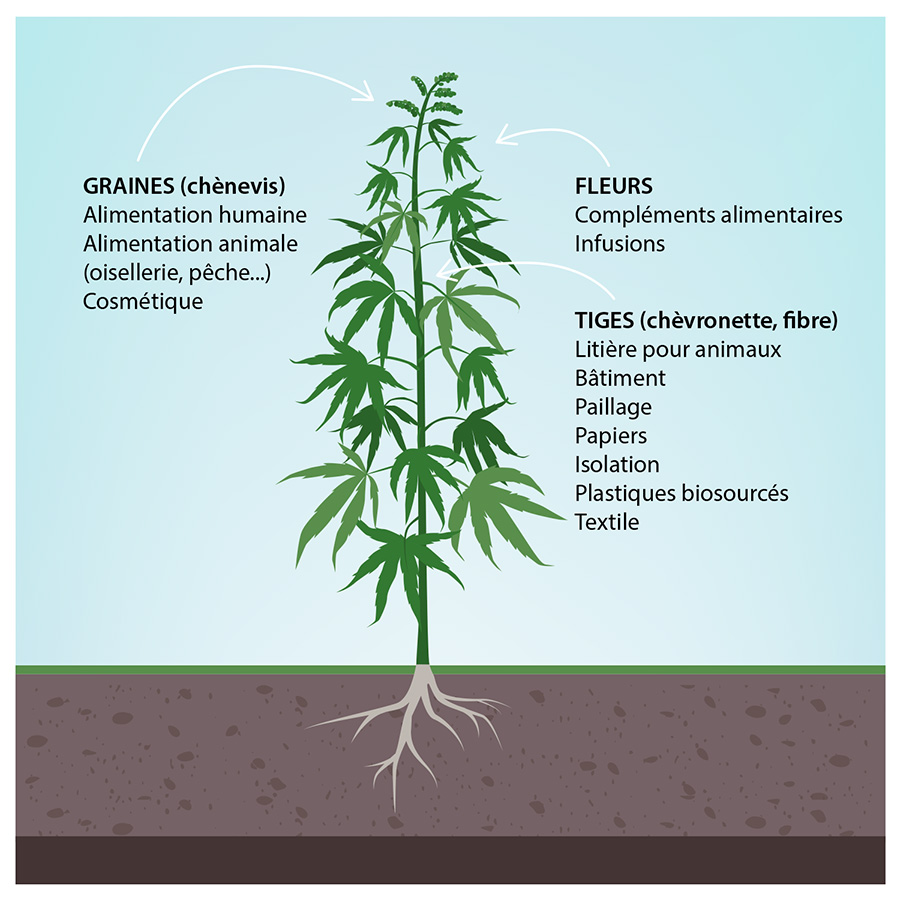
- À partir de ses fleurs séchées comme remède ou comme pratique religieuse ou festive.
Ses différentes orientations sont le résultat de nombreux croisements de culture sur plusieurs générations.
L’orientation du chanvre vers des utilisations médicinales, cultuelles ou récréatives avait impulsé au fil du temps la sélection d’une variété de chanvre communément appelé marijuana doté de certains effets psychiques recherchés : ce chanvre dit psychotrope, appelé aussi « cannabis », reste pour l’instant encore totalement interdit en France car classifié comme substance « stupéfiante » et donc illégale quant à sa production, sa commercialisation et sa consommation.
L’autre chanvre dit « industriel », a donné lieu jusqu’à aujourd’hui à des sous-espèces spécialisées restreintes dans la production de fibres, de graines, de cellulose et dont la culture est autorisée sous de strictes conditions. Ce chanvre se doit de ne pas dépasser 0,2 % de THC, seuil légal de concentration maximale. Attention, ce pourcentage ne concerne que la plante et les graines, et non pas le produit fini à base de chanvre, qui doit lui contenir 0 % de THC, ou de simples traces sous peine de se placer dans l’ilégalité.
Le chanvre industriel
La Fédération Nationale des Producteurs de Chanvre (FNPC), en accord avec les arrêtés du Code de la Santé Publique, a mis au point des variétés de chanvre Cannabis sativa L. possédant un taux de THC inférieur à 0,2 %.
Ces graines sont les seules désormais certifiées à la culture en France. Certains pays non européens acceptent un taux de THC de 0,3 jusqu’à 1 % (Suisse).
À ce jour, neuf variétés françaises inscrites au Code de la Santé publique sont autorisées à la culture en France, mais il est aussi possible de cultiver certaines variétés étrangères pour peu qu’elles soient inscrites au catalogue communautaire.
Parmi elles, on peut distinguer celles destinées à produire des fibres, d’autres des graines, d’autres réservées pour la production d’huile et de cellulose.
Aujourd'hui, la France reste le principal producteur de semence de chanvre en Europe avec environ 17 000 hectares cultivés, contre 10 fois plus au 19ème siècle.
Les 3 principales variétés de chanvre psychotrope
Ces variétés de chanvre psychotrope sont connues dans le monde sous plus de 350 dénominations différentes (marijuana, haschich, shit, ganja, kif, beuh, etc.) et font l’objet de nombreuses recherches actuelles pour leur développement médical et de bien-être.
Elles peuvent être fumées, inhalées, prises en infusion, en teinture mère ou en gouttes sublinguales, mais existent aussi sous formes pharmaceutiques prescrites par les médecins dans certaines conditions.
On peut distinguer trois variétés de chanvre psychotrope :
- Le Cannabis indica illégal en France,
- Le Cannabis sativa légal en France si sa teneur en THC est inférieure à 0,2% dans la plante en culture,
- Le cannabis à CBD légal en France si sa teneur en THC est inférieure à 0,2% dans la plante en culture.
Rappelons que la loi française demande à ne pas présenter le cannabis considéré comme stupéfiant sous un jour favorable pour ne pas tomber sous le coup de la provocation au délit (article L3421-4 du code de la santé publique).
Le chanvre est constitué de différentes molécules, appelées phyto-cannabinoïdes. Parmi elles, le cannabidiol appelé plus couramment CBD, aux nombreuses propriétés découvertes récemment.
Focus sur le CBD
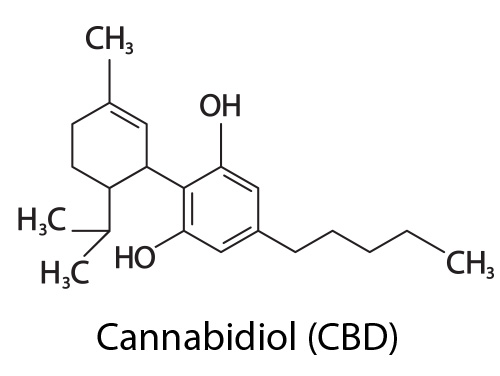
Le cannabidiol (CBD) est le deuxième phytocannabinoïde le plus étudié après le THC. Il présente une concentration de 0,1 à 2,9 % par unité de matière sèche de chanvre.
Découverte dans les années quarante, cette molécule était étonnamment considérée à l’époque comme toxique.
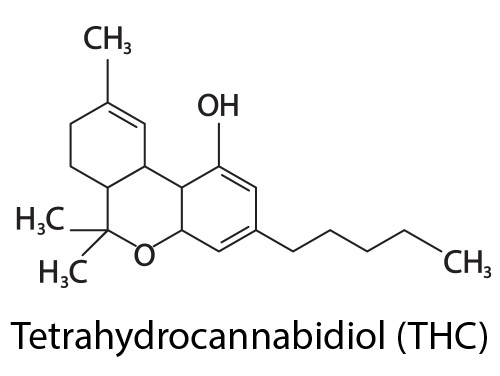
Sur le plan moléculaire, le THC et le CBD possèdent tous les deux 21 atomes de carbone, 3 atomes d’hydrogène et deux atomes d’oxygène : ils diffèrent simplement par la position d’un seul atome d’hydrogène. Malgré cette structure moléculaire extrêmement proche, le CBD n’exerce pas d’effet psychotrope à type d’ivresse ou d’euphorie.
Les deux principaux phytocannabinoïdes :
Le CBD fait l’objet de nombreuses études et d’une attention particulière du monde scientifique tellement le potentiel thérapeutique du CBD apparaît immense, tout en offrant peu d’effets indésirables et une faible toxicité.
Il existe à ce jour plus de 1 500 références scientifiques sur le CBD dont la moitié a été publiée ces 5 dernières années.
Le CBD est la substance active principale présente dans trois médicaments : le Sativex®, l'Epidiolex® et le Cannador®.
Propriétés et utilisations du CBD
Rappelons que les seuls médicaments à base de CBD qui existent comme l’Epidiolex®, le Sativex® et le Cannador® sont réservés officiellement au traitement de pathologies sévères ou résistantes aux soins conventionnels comme les crises épileptiques de l'enfant, les spasmes musculaires de la sclérose en plaques ou la cachexie des personnes atteintes de cancer avancé.
Cela étant, des professionnels de santé, hors hexagone, emploient également le CBD dans la toxicomanie, l'inflammation, les troubles anxieux, la douleur et les nausées, ainsi que pour inhiber la croissance de cellules cancéreuses. Des publications récentes démontrent même une certaine efficacité dans la schizophrénie et dans les troubles du tonus musculaire.
Plusieurs études ont prouvé ses propriétés antioxydantes, anxiolytiques, antiémétiques, antipsychotiques et neuroprotectrices.
Le CBD une substance adaptogène ?
Rappelons que la propriété « adaptogène » se définit par la capacité d’une plante ou d’une substance végétale à augmenter les capacités de défense d’un organisme à tout type de stress (physique, psychique, chimique…), de façon non spécifique, sans viser de cible particulière (organe, pathologie, organisme entier), via plusieurs actions polyvalentes simultanées sur différents mécanismes biologiques, tout en bénéficiant d’un excellent profil toxicologique.
Une revue de littérature sur le CBD nous fait comprendre qu’elle répond point par point à cette définition : plusieurs études décrivent effectivement le CBD comme une molécule multicible, agissant grâce à des effets modulateurs sur différents niveaux cellulaires, tissulaires et organiques principalement par l’intermédiaire des récepteurs CB1 et CB2.
Le CBD est particulièrement actif sur les troubles de l’humeur, les troubles du sommeil, le stress chronique, les addictions, les psychoses, l’épilepsie, la prévention cardiovasculaire et neurodégénérative.
On lui reconnaît également des propriétés anti-inflammatoires et antalgiques avec un effet de modulation positive sur le système immunitaire.
Le profil toxicologique du CBD et son rapport « bénéfice-risque » sont en sa faveur avec des effets secondaires rapportés rares et bénins, sans les effets et risques connus du THC.
Pour toutes ces raisons, on peut désormais considérer le CBD comme un adaptogène de nouvelle génération agissant par le système endocannabinoïde.
Effets antalgiques et anti-inflammatoires du CBD
Le CBD exerce plusieurs effets pharmacologiques bénéfiques comme notamment des activités analgésiques et anti-inflammatoires médiées par l'inhibition de la cyclooxygénase et de la lipoxygénase.
Cette action anti-inflammatoire est plusieurs centaines de fois supérieures à celle de l'acide acétylsalicylique (aspirine).
De plus, le cannabidiol inhibe la synthèse du leucotriène TXB4 dans les globules blancs (polynucléaires).
Le CBD a démontré des effets positifs sur l’inflammation articulaire, de la cornée, du côlon, de l’encéphale, de la myéline (la gaine des nerfs), du pancréas et du tissu pulmonaire pour les plus étudiés.
La recherche s’oriente actuellement pour l’élaboration de gel et de solutions orales à base de CBD destinés à soulager les maladies inflammatoires humaines communes.
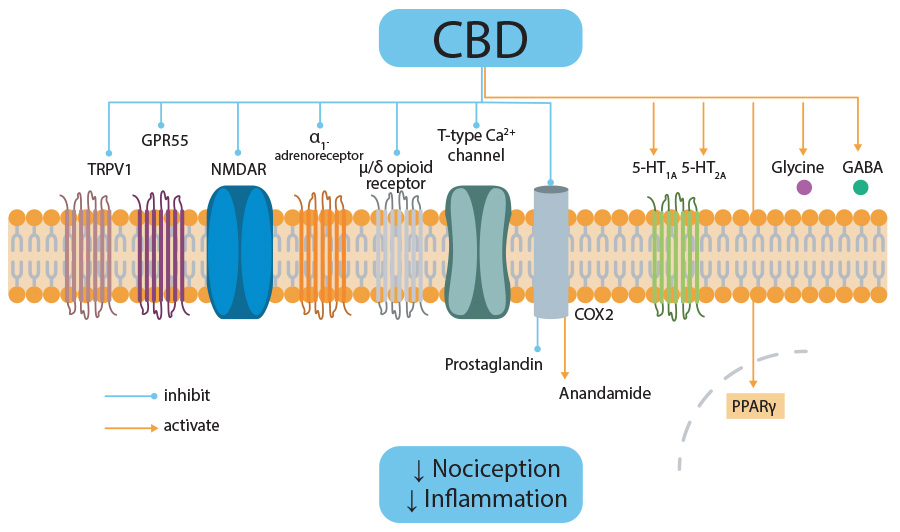
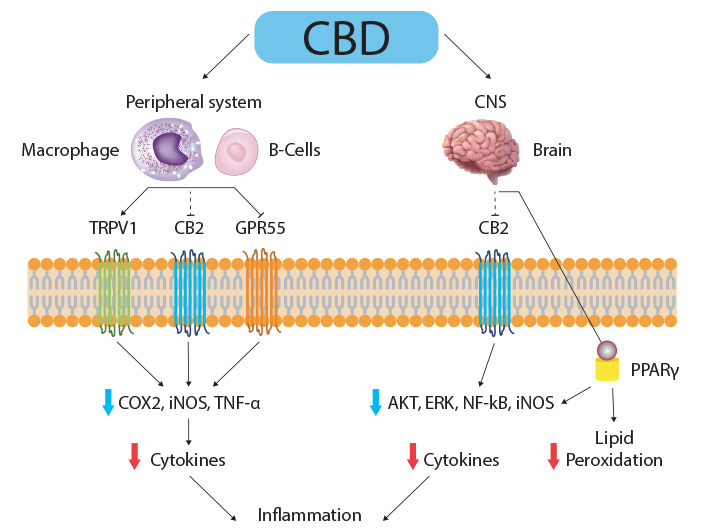
Les effets analgésiques du CBD peuvent être dus à la suppression des récepteurs TRPV1, GPR55, NMDAR et 1-adrénergiques, des canaux Ca +2 de type T et des récepteurs -/δ-opioïdes en plus de l'activation du 5HT1A, de l'adénosine A2, de la glycine, des récepteurs GABA et PPAR-γ.
Le CBD peut également diminuer les prostaglandines nociceptives et inflammatoires et produire une augmentation indirecte du niveau d'endocannabinoïdes, d'anandamide et de 2-AG, en supprimant la COX2 (comme les anti-inflammatoires de référence). Le CBD est actif également sur d’autres systèmes impliqués dans la douleur comme les récepteurs vanilloïdes, le système sérotoninergique et le système opioïde.
Anti-inflammatory actions of CBD
|
Response |
Model |
|
|
Immunité et CBD
Le CBD a démontré sa capacité à réguler positivement les médiateurs biologiques de l’immunité cellulaire (lymphocytes T) et humorale (cytokines, interleukines…) sur des modèles animaux de maladies auto-immunes comme la sclérose en plaques (SEP).
Des patients transplantés prenant du CBD ont montré une réduction importante du risque de rejet de greffe (GVHD).
Le CBD a révélé également son pouvoir modérateur des réactions d’hypersensibilité retardée et immédiate, impliquées dans les pathologies pulmonaires obstructives comme l’asthme et dans la dermite allergique de contact.
Protection cérébrale, humeur, stress et CBD
 Le CBD exerce une protection des neurones et des nerfs. Il stimule la production d’anandamide, impliqué dans la gestion des émotions, de la douleur, de la mémoire, de l’activité motrice, de la cognition, de l’addiction et de la prise alimentaire.
Le CBD exerce une protection des neurones et des nerfs. Il stimule la production d’anandamide, impliqué dans la gestion des émotions, de la douleur, de la mémoire, de l’activité motrice, de la cognition, de l’addiction et de la prise alimentaire.
Il a d’ailleurs été démontré que des concentrations élevées de CBD stimulent le récepteur de la sérotonine (5-HT1A), exerçant des effets antidépresseurs.
Le CBD apparaît efficace dans la prise en charge des syndromes de stress post-traumatique et sur les troubles anxieux.
Des études positionnent le CBD comme un traitement complémentaire pour soulager les symptômes de la maladie psychotique, de la maladie d’Alzheimer et de la dépression sévère.
D’autres expérimentations convergent pour le proposer dans les troubles du tonus musculaire de la maladie de Parkinson.
Le CBD peut, en fonction de la dose et de la sensibilité de la personne, améliorer les troubles du sommeil.
CBD et cancer
Comme le THC, le CBD possède une action directe anticancéreuse, et plus spécifique encore : des chercheurs californiens ont démontré que le CBD pouvait réduire l’expression de certains gènes responsables de la diffusion métastatique de nombreux cancers comme celui du sein, de la prostate ou du glioblastome, donc en réduisant considérablement leur agressivité.
On sait que le CBD empêche également la formation des vaisseaux nourriciers des tumeurs (angiogenèse), favorise la mort des cellules cancéreuses (apoptose) tout en inhibant leur multiplication. Il améliore également l’efficacité et la tolérance des radiothérapies et des chimiothérapies en permettant d’en diminuer substantiellement les doses et de cibler au mieux les cancers sensibles.
L’anandamide, endocannabinoïde dont la production est augmentée par le CBD, a montré récemment sa capacité à inhiber la prolifération des cellules cancéreuses du sein.
Dans les modèles animaux, il a été démontré que le CBD inhibe la progression de plusieurs types de cancer.
Effet antiépileptique du CBD
Des travaux en cours de validation suggèrent que le CBD pourrait donc être indiqué pour traiter les formes sévères d’épilepsie de l’enfant résistantes aux médicaments conventionnels, ou même en substitution avec une efficacité équivalente, sans les effets secondaires mal supportés usuellement.
Des études ont notamment déjà montré que chez les enfants et les adultes atteints du syndrome de Lennox-Gastaut, l'ajout de cannabidiol à une dose de 10 ou 20 mg/kg/j à un régime antiépileptique conventionnel a entraîné des réductions plus importantes de la fréquence des crises convulsives que le placebo. Les résultats préliminaires soutiennent que le CBD représente un traitement complémentaire efficace sur le long terme des épilepsies rebelles de l’enfant (syndrome de Dravet et syndrome de Lennox-Gastaut).
Le CBD était généralement bien toléré ; ses effets indésirables les plus courants étaient la diarrhée (29 %) et la somnolence (22 %) et des élévations des transaminases hépatiques à ces doses importantes.
CBD et addictions
Les résultats d’études récentes, justifiant des expérimentations de grande échelle, montrent que les personnes ayant reçu du CBD ont pu réduire de 40 % leur consommation de cigarettes. D’autres, que des doses de 400 mg et 800 mg quotidiens de CBD se sont révélées sûres et plus efficaces que le placebo pour réduire la consommation de cannabis en comparant les temps d’abstinence.
De façon contre-intuitive, le CBD représente une arme de choix pour se sevrer du chanvre psychotrope.
Confortés par des études, certains spécialistes de l’addiction proposent maintenant de passer au CBD comme substance de renoncement pour se sevrer de drogues plus dures comme l’alcool, les opiacés et la cocaïne.
CBD et autres propriétés thérapeutiques
Le CBD peut être indiqué dans les nausées et les vomissements, et même en association avec des antiémétiques de référence qu’il potentialise.
Le CBD pourrait permettre de lutter contre l’ostéoporose en réduisant la résorption osseuse via le récepteur CPR55 qu’il stimule.
Métabolisation du CBD
Le CBD est un puissant inhibiteur d’enzymes du foie (CYP2D6, CYP2C19) avec une élimination lente essentiellement biliaire et urinaire. À ce titre, le CBD interagit potentiellement avec nombre de médicaments en modifiant leur activité et réciproquement : la prudence sera de mise en cas de prise concomitante de CBD à forte dose et d’un traitement médicamenteux au long cours.
Le CBD se révèle très peu toxique chez l’être humain avec des doses jusqu’à 1 500 milligrammes par jour très bien tolérés et qui ont été testées dans les études.
La faible biodisponibilité orale des cannabinoïdes est attribuée au métabolisme de premier passage dans le tissu hépatique.
Le CBD administré par voie orale est largement transformé en un métabolite inactif, appelé le 7-OH-CBD : Il possède donc une faible biodisponibilité orale pour atteindre le niveau plasmatique maximal de 2 heures.
L'absorption du CBD peut être améliorée en utilisant un véhicule huileux tel que l'huile de chanvre, au travers d’une administration sublinguale par exemple. Il s’agit de la plus conseillée pour éviter aussi le premier passage hépatique rendant le CBD inactif et pour un effet rapide.
La présentation se fait en extrait liquide huileux, aqueux ou glycérine contenant un pourcentage variable de CBD par unité de volume.
Quid du CBD synthétique ?Un CBD synthétique existe, qui est produit sans chanvre grâce à des levures génétiquement modifiées avec du fluor ou du bromure. Il s’apparente à du CBD hydrogéné appelé « H2CBD » de formule 8,9-dihydrocannabidiol. Il est présenté souvent comme aussi efficace que le CBD naturel et sans aucun effet secondaire. Il semble cela étant que d’autres récepteurs biologiques autres que les récepteurs CB1 et 2 puissent être atteints par le CBD de synthèse et différents de ceux visés par le CBD naturel issu du chanvre. Une étude californienne parue dans Journal of Medical Phyto Research, a comparé la concentration sérique d’enzymes hépatiques de deux groupes témoins pendant 22 semaines ; le premier groupe prenant du CBD naturel et le second prenant du CBD synthétique. Le deuxième groupe a montré des niveaux élevés d’alanine amine transférase (ALT) et d’aspartate aminé transférase (AST). L’étude a donc conclu que l’organisme humain ne semble pas adapté pour métaboliser correctement les cannabinoïdes synthétiques. En été 2018, la FDA a publié une déclaration mettant en garde contre les risques importants pour la santé des produits à base de cannabinoïdes synthétiques. Des maladies graves et même des décès ont été rapportés dans un certain nombre d’États d’Amérique. |
Cet article a été rédigé par le Dr. Franck GIGON, médecin-nutritionniste à Millau (12). |
Références
-Pellati F, Borgonetti V, Brighenti V, Biagi M, Benvenuti S, Corsi L. Cannabis sativa L. and Nonpsychoactive Cannabinoids: Their Chemistry and Role against Oxidative Stress, Inflammation, and Cancer. Biomed Res Int. 2018 Dec 4;2018:1691428.
-Larsen C, Shahinas J. Dosage, Efficacy and Safety of Cannabidiol Administration in Adults: A Systematic Review of Human Trials. J Clin Med Res. 2020 Mar;12(3):129-141.
-Britch SC, Babalonis S, Walsh SL. Cannabidiol: pharmacology and therapeutic targets. Psychopharmacology (Berl). 2021 Jan;238(1):9-28.
-Singer L, Tokish H, Park F, Campisi C, Milanaik RL. The cannabidiol conundrum: potential benefits and risks of cannabidiol products for children. Curr Opin Pediatr. 2020 Feb;32(1):198-205.
-Laux LC, Bebin EM, Checketts D, Chez M, Flamini R, Marsh ED, Miller I, Nichol K, Park Y, Segal E, Seltzer L, Szaflarski JP, Thiele EA, Weinstock A; CBD EAP study group. Long-term safety and efficacy of cannabidiol in children and adults with treatment resistant Lennox-Gastaut syndrome or Dravet syndrome: Expanded access program results. Epilepsy Res. 2019 Aug;154:13-20.
-Meissner H, Cascella M. Cannabidiol (CBD). 2021 Jan 16. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021 Jan–. PMID: 32310508.
- Maayah ZH, Takahara S, Ferdaoussi M, Dyck JRB. The molecular mechanisms that underpin the biological benefits of full-spectrum cannabis extract in the treatment of neuropathic pain and inflammation. Biochim Biophys Acta Mol Basis Dis. 2020 Jul 1;1866(7):165771.
- Maayah ZH, Takahara S, Ferdaoussi M, Dyck JRB. The molecular mechanisms that underpin the biological benefits of full-spectrum cannabis extract in the treatment of neuropathic pain and inflammation. Biochim Biophys Acta Mol Basis Dis. 2020 Jul 1;1866(7):165771.
-Ali S, Scheffer IE, Sadleir LG. Efficacy of cannabinoids in paediatric epilepsy. Dev Med Child Neurol. 2018 Nov 6.
-Bakshi C, Barrett AM. Impact of recreational and medicinal marijuana on surgical patients: A review. Am J Surg. 2018 Nov 14.
-Beale C, Broyd SJ, Chye Y et al. Prolonged Cannabidiol Treatment Effects on Hippocampal Subfield Volumes in Current Cannabis Users. Cannabis Cannabinoid Res. 2018 Apr 1;3(1):94-107.
-Baron EP. Medicinal Properties of Cannabinoids, Terpenes, and Flavonoids in Cannabis, and Benefits in Migraine, Headache, and Pain: An Update on Current Evidence and Cannabis Science. Headache. 2018 Jul;58(7):1139-1186.
-Callaway JC. Hempseed as a nutritional resource: An overview. Department of Pharmaceutical Chemistry, Un-Chagas MH, Eckeli AL, Zuardi AW et al. Cannabidiol can improve complex sleep-related behaviours associated with rapid eye movement sleep behaviour disorder in Parkinson’s disease patients: a case series. J Clin Pharm Ther. 2014 Oct;39(5):564-6.
-Darkovska-Serafimovska M, Serafimovska T, Arsova-Sarafinovska Z et al. Pharmacotherapeutic considerations for use of cannabinoids to relieve pain in patients with malignant diseases. J Pain Res. 2018 Apr 23;11:837-842.
-Diamond I, Yao L. From Ancient Chinese Medicine to a Novel Approach to TreatCocaine Addiction. CNS Neurol Disord Drug Targets. 2015;14(6):716-26. Review.
-Fournier G. 2000. La sélection du chanvre à fibres (Cannabis sativa L.) en France. Chanvre et THC. C. R. Acad. Agric. France 86: 209–217.
-Girgih AT, Udenigwe CC, Aluko RE. Reverse-phase HPLC separation of hemp seed (Cannabis sativa L.) protein hydrolysate produced peptide fractions with enhanced antioxidant capacity. Plant Foods Hum Nutr. 2013 Mar;68(1):39-46.
-Gonzalez-Cuevas G, Martin-Fardon R, Kerr TM et al F. Unique treatment potential of cannabidiol for the prevention of relapse to drug use: preclinical proof of principle. Neuropsychopharmacology. 2018 Sep;43(10):2036-2045.
-Grotenhermen F. Chanvre en médecine. Redécouverte d’une plante médicinale. Éditions solanacée
-Grucza, Rick and Vuolo, Mike and Krauss, Melissa and Plunk, Andrew and Agrawal, Arpana and Chaloupka, Frank J. and Bierut, Laura, Cannabis Decriminalization: A Study of Recent Policy Change in Five U.S. States (June 14, 2018).
-Hausman-Kedem M, Menascu S, Kramer U. Efficacy of CBD-enriched medical cannabis for treatment of refractory epilepsy in children and adolescents – An observational, longitudinal study. Brain Dev. 2018 Aug;40(7):544-551.
-Li SY, Stuart JD, Li Y, Parnas RS. The feasibility of converting Cannabis sativa L. oil into biodiesel. Bioresour Technol. 2010 Nov;101(21):8457-60.
-López-Valero I, Saiz-Ladera C, Torres S et al. Targeting Glioma Initiating Cells with A combined therapy of cannabinoids and temozolomide. Biochem Pharmacol. 2018 Nov;157:266-274.
-López-Valero I, Torres S, Salazar-Roa M et al. Optimization of a preclinical therapy of cannabinoids in combination with temozolomide against glioma. Biochem Pharmacol. 2018 Nov;157:275-284.
-Luján MÁ, Castro-Zavala A, Alegre-Zurano L, Valverde O. Repeated Cannabidiol treatment reduces cocaine intake and modulates neural proliferation and CB1R expression in the mouse hippocampus. Neuropharmacology. 2018 Sep 28; 143:163-175.
-Massin S. Approches économiques normatives et positives de la législation sur les drogues. Psychotropes. 2013/1 (Vol 19).
-Mihoc M, Pop G, Alexa E, Radulov I. Nutritive quality of romanian hemp varieties (Cannabis sativa L.) with special focus on oil and metal contents of seeds. Chem Cent J. 2012 Oct 23;6(1):122.
-Morgan CJ, Das RK, Joye A et al. Cannabidiol reduces cigarette consumption in tobacco smokers: preliminary findings. Addict Behav. 2013 Sep;38(9):2433-6.
-Noel C. Evidence for the use of «medical marijuana» in psychiatric and neurologic disorders. Ment Health Clin. 2018 Mar 23;7(1):29-38.
-Noreen N, Muhammad F, Akhtar B, Azam F, Anwar MI. Is Cannabidiol a Promising Substance for New Drug Development? A Review of its Potential Therapeutic Applications. Crit Rev Eukaryot Gene Expr. 2018;28(1):73-86.
-Petrosino S, Verde R, Vaia M et al. Anti-inflammatory Properties of Cannabidiol, a Nonpsychotropic Cannabinoid, in Experimental Allergic Contact Dermatitis. J Pharmacol Exp Ther. 2018 Jun;365(3):652-663.
-Rodríguez-Muñoz M, Onetti Y, Cortés-Montero E et al. Cannabidiol enhances morphine antinociception, diminishes NMDA-mediated seizures and reduces stroke damage via the sigma 1 receptor. Mol Brain. 2018 Sep 17;11(1):51.
-Scharf EL. Translating Endocannabinoid Biology into Clinical Practice: Cannabidiol for Stroke Prevention. Cannabis Cannabinoid Res. 2017 Oct 1;2(1):259-264.
-Solimini R, Rotolo MC, Pichini S, Pacifici R. Neurological Disorders in Medical Use of Cannabis: An Update. CNS Neurol Disord Drug Targets. 2017;16(5):527-533. doi: 10.2174 /1871527316666170413105421. Review.
-Solowij N, Broyd SJ, Beale C et al. Therapeutic Effects of Prolonged Cannabidiol Treatment on Psychological Symptoms and Cognitive Function in Regular Cannabis Users: A Pragmatic Open-Label Clinical Trial. Cannabis Cannabinoid Res. 2018 Mar 1;3(1):21-34.
-Sultan AS, Marie MA, Sheweita SA. Novel mechanism of cannabidiol-induced apoptosis in breast cancer cell lines. Breast. 2018 Oct;41:34-41.
-Thapa D, Cairns EA, Szczesniak AM et al. The Cannabinoids Δ(8)THC, CBD, and HU-308 Act via Distinct Receptors to Reduce Corneal Pain and Inflammation. Cannabis Cannabinoid Res. 2018 Feb 1;3(1):11-20.
-Thouminot C. La sélection française du chanvre : panorama et perspectives. OCL 2015, 22(6) D603
-Whiting PF, Wolff RF, Deshpande S et al. Cannabinoids for Medical Use: A Systematic Review and Meta-analysis. JAMA. 2015 Jun 23-30;313(24):2456-73.
-Zaheer S, Kumar D, Khan MT et al. Epilepsy and Cannabis: A Literature Review. Cureus. 2018 Sep 10;10(9):e3278.
-University of Kuopio – 2004
-Gurley BJ, Murphy TP, Gul W, Walker LA, ElSohly M. Content versus Label Claims in Cannabidiol (CBD)-Containing Products Obtained from Commercial Outlets in the State of Mississippi. J Diet Suppl. 2020;17(5):599-607.
CBD et douleur
-Thapa D, Cairns EA, Szczesniak AM et al. The Cannabinoids Δ(8)THC, CBD, and HU-308 Act via Distinct Receptors to Reduce Corneal Pain and Inflammation. Cannabis Cannabinoid Res. 2018 Feb 1;3(1):11-20.
-Baron EP. Medicinal Properties of Cannabinoids, Terpenes, and Flavonoids in Cannabis, and Benefits in Migraine, Headache, and Pain: An Update on Current Evidence and Cannabis Science. Headache. 2018 Jul;58(7):1139-1186.
-Blake A, Wan BA, Malek L, DeAngelis C, Diaz P, Lao N, Chow E, O’Hearn S. A selective review of medical cannabis in cancer pain management. Ann Palliat Med. 2017 Dec;6(Suppl 2):S215-S222.
-Darkovska-Serafimovska M, Serafimovska T, Arsova-Sarafinovska Z et al. Pharmacotherapeutic considerations for use of cannabinoids to relieve pain in patients with malignant diseases. J Pain Res. 2018 Apr 23; 11:837-842.
-Rodríguez-Muñoz M, Onetti Y, Cortés-Montero E et al. Cannabidiol enhances morphine antinociception, diminishes NMDA-mediated seizures and reduces stroke damage via the sigma 1 receptor. Mol Brain. 2018 Sep 17;11(1):51.
CBD et neuroprotection
-Santiago AN, Mori MA, Guimarães FS et al. Effects of Cannabidiol on Diabetes Outcomes and Chronic Cerebral Hypoperfusion Comorbidities in Middle-Aged Rats. Neurotox Res. 2018 Nov 14
-Scharf EL. Translating Endocannabinoid Biology into Clinical Practice: Cannabidiol for Stroke Prevention. Cannabis Cannabinoid Res. 2017 Oct 1;2(1):259-264.
-Rodríguez-Muñoz M, Onetti Y, Cortés-Montero E et al. Cannabidiol enhances morphine antinociception, diminishes NMDA-mediated seizures and reduces stroke damage via the sigma 1 receptor. Mol Brain. 2018 Sep 17;11(1):51.
-Maroon J, Bost J. Review of the neurological benefits of phytocannabinoids.Surg Neurol Int. 2018 Apr 26;9:91.
-Hughes B, Herron CE. Cannabidiol Reverses Deficits in Hippocampal LTP in a Model of Alzheimer’s Disease. Neurochem Res. 2018 Mar 24.
-Noel C. Evidence for the use of «medical marijuana» in psychiatric and neurologic disorders. Ment Health Clin. 2018 Mar 23;7(1):29-38.
CBD et immunité
-Rezapour-Firouzi S, Arefhosseini SR, Mehdi F, et al. Immunomodulatory and therapeutic effects of Hot-nature diet and co-supplemented hemp seed, evening primrose oils intervention in multiple sclerosis patients. Complement Ther Med. 2013 Oct ;21(5):473-80.
-Lucas CJ, Galettis P, Schneider J. The Pharmacokinetics and the Pharmacodynamics of Cannabinoids. Br J Clin Pharmacol. 2018 Jul 12.
-Li Y, Yang R, Hu X, Long Z, et al. [Initial study of Hemp seeds protein on antifatigue and the immunomodulation effects in mice]. Wei Sheng Yan Jiu. 2008 Mar;37(2):175-8. Chinese.
-Petrosino S, Verde R, Vaia M et al. Anti-inflammatory Properties of Cannabidiol, a Non psychotropic Cannabinoid, in Experimental Allergic Contact Dermatitis. J Pharmacol Exp Ther. 2018 Jun;365(3):652-663.
-Palmieri B, Laurino C, Vadalà M. Short-Term Efficacy of CBD-Enriched Hemp Oil in Girls with Dysautonomic Syndrome after Human Papillomavirus Vaccination. Isr Med Assoc J. 2017 Feb;19(2):79-84.
CBD et épilepsie
-Ali S, Scheffer IE, Sadleir LG. Efficacy of cannabinoids in paediatric epilepsy. Dev Med Child Neurol. 2018 Nov 6.
- Hausman-Kedem M, Menascu S, Kramer U. Efficacy of CBD-enriched medical cannabis for treatment of refractory epilepsy in children and adolescents – An observational, longitudinal study. Brain Dev. 2018 Aug;40(7):544-551.
- Stockings E, Zagic D, Campbell G et al. Evidence for cannabis and cannabinoids for epilepsy: a systematic review of controlled and observational evidence. J Neurol Neurosurg Psychiatry. 2018 Jul;89(7):741-753.
-Zaheer S, Kumar D, Khan MT et al. Epilepsy and Cannabis: A Literature Review. Cureus. 2018 Sep 10;10(9):e3278.
CBD et addiction
-Babalonis S, Haney M, Malcolm RJ et al. Oral cannabidiol does not produce a signal for abuse liability in frequent marijuana smokers. Drug Alcohol Depend. 2017 Mar 1;172:9-13.
-Diamond I, Yao L. From Ancient Chinese Medicine to a Novel Approach to TreatCocaine Addiction. CNS Neurol Disord Drug Targets. 2015;14(6):716-26. Review.
-Gonzalez-Cuevas G, Martin-Fardon R, Kerr TM et al F. Unique treatment potential of cannabidiol for the prevention of relapse to drug use: preclinical proof of principle. Neuropsychopharmacology. 2018 Sep;43(10):2036-2045.
-Luján MÁ, Castro-Zavala A, Alegre-Zurano L, Valverde O. Repeated Cannabidiol treatment reduces cocaine intake and modulates neural proliferation and CB1R expression in the mouse hippocampus. Neuropharmacology. 2018 Sep 28;143:163-175.
-Morgan CJ, Das RK, Joye A et al. Cannabidiol reduces cigarette consumption in tobacco smokers: preliminary findings. Addict Behav. 2013 Sep;38(9):2433-6.
-Navarrete F, Aracil-Fernández A, Manzanares J. Cannabidiol regulates behavioural alterations and gene expression changes induced by spontaneous cannabinoid withdrawal. Br J Pharmacol. 2018 Jul;175(13):2676-2688.
Cannabidoïdes et opioïdes
-Nielsen S, Sabioni P, Trigo JM, Ware MA, Betz-Stablein BD, Murnion B, Lintzeris N, Khor KE, Farrell M, Smith A, Le Foll B. Opioid-Sparing Effect of Cannabinoids: A Systematic Review and Meta-Analysis. Neuropsychopharmacology. 2017 Aug;42(9):1752-1765. doi: 10.1038/ npp.2017.51. Epub 2017 Mar 22. Review.
-Grenald SA, Young MA, Wang Y, Ossipov MH, Ibrahim MM, Largent-Milnes TM, Vanderah TW. Synergistic attenuation of chronic pain using mu opioid and cannabinoid receptor 2 agonists. Neuropharmacology. 2017 Apr;116:59-70.
CBD et cancer
-McAllister SD, Soroceanu L, Desprez PY. The Antitumor Activity of Plant-Derived Non-Psychoactive Cannabinoids. J Neuroimmune Pharmacol. 2015 Jun;10(2):255-67.
-Sultan AS, Marie MA, Sheweita SA. Novel mechanism of cannabidiol-induced apoptosis in breast cancer cell lines. Breast. 2018 Oct;41:34-41.
- Jeong S, Yun HK, Jeong YA, Jo MJ, Kang SH, Kim JL, Kim DY, Park SH, Kim BR, Na YJ, Lee SI, Kim HD, Kim DH, Oh SC, Lee DH. Cannabidiol-induced apoptosis is mediated by activation of Noxa in human colorectal cancer cells. Cancer Lett. 2019 Apr 10; 447:12-23.
-Kosgodage US, Mould R, Henley AB et al. Cannabidiol (CBD) Is a Novel Inhibitor for Exosome and Microvesicle EMV) Release in Cancer. Front Pharmacol. 2018 Aug 13; 9:889.
CBD et interaction médicamenteuse
-Rong C, Carmona NE, Lee YL, Ragguett RM, Pan Z, Rosenblat JD, Subramaniapillai M, Shekotikhina M, Almatham F, Alageel A, Mansur R, Ho RC, McIntyre RS. Drug-drug interactions as a result of co-administering Δ(9)-THC and CBD with other psychotropic agents. Expert Opin Drug Saf. 2018 Jan;17(1):51-54. doi: 10.1080/14740338.2017.1397128. Epub 2017 Oct 31. Review.
-Opitz BJ, Ostroff ML, Whitman AC. The Potential Clinical Implications and
Importance of Drug Interactions Between Anticancer Agents and Cannabidiol in Patients with Cancer. J Pharm Pract. 2019 Feb 18:897190019828920.
-Grayson L, Vines B, Nichol K, Szaflarski JP; UAB CBD Program. An interaction between warfarin and cannabidiol, a case report. Epilepsy Behav Case Rep. 2017 Oct 12; 9:10-11.
-Gaston TE, Bebin EM, Cutter GR, Liu Y, Szaflarski JP; UAB CBD Program. Interactions between cannabidiol and commonly used antiepileptic drugs. Epilepsia. 2017 Sep;58(9):1586-1592.


