Depuis une dizaine d’années, le monde du sport d’endurance a subi une évolution vers des épreuves de plus en plus longues et éprouvantes pour les organismes. On voit désormais fleurir de plus en plus de courses de longues voire très longues distances, qui étaient réservées jusqu’à présent à une élite ultra-entraînée. Trail, ultra-trail rivalisent d’imagination et de difficulté pour mettre à mal le corps des sportifs : 60 km, 100 km, les distances ne cessent d’augmenter. Le graal, la célèbre course UTMB pour ultra-trail du Mont blanc permet à plus de 1 500 coureurs de parcourir 171 km balisés en pleine montagne, avec un dénivelé de plus de 10 000 m positif.
Le sportif doit alors faire face à un grand nombre de problèmes à résoudre : comment s’alimenter, s’hydrater ? Quels sont les problèmes inhérents à la course à pied ? Comment y remédier ? Ceci bien sûr est un véritable enjeu pour les courses extrêmes, mais s’applique également sur les courses plus courtes.
Que sont les troubles digestifs à l’effort ?
Les férus de Jeux Olympiques se souviennent sûrement des déboires survenus au marcheur français Yohann Dinitz aux J.O. de Rio en 2016. Alors qu’il marchait sur l’épreuve olympique, seul en tête à mi-parcours et en route pour ce qui devait être l’acmé de sa carrière de sportif international, il fut subitement pris de douleurs au ventre. Tiraillé entre l’envie d’abandonner et le courage de continuer, les images montrèrent l’état de son short et de ses jambes maculées de diarrhée. Cet exemple résume à lui seul la complexité de la prise en charge des sportifs d’endurance. Les derniers repas, l’état du microbiote, l’alimentation et l’hydratation lors de l’épreuve peuvent tout aussi bien transformer vos milliers d’heures d’entraînement en un jour de gloire ou en jour de cauchemar.
Une étude sur 63 marathoniens a ainsi pu mettre en évidence (Halvorsen et al., 1986) que 54 % des fondeurs souffrent de troubles digestifs, dont 20 % de diarrhées post-entraînement. Enfin, du sang a été retrouvé dans les selles de 13 % des coureurs.
Une autre étude sur des triathlètes a pu affiner et mettre en lumière la différence de ces troubles selon l’activité d’endurance (Rehrer et al., 1992) : 49 % des sujets interrogés ont indiqué avoir des troubles digestifs, le plus souvent pendant la course à pied, 93 % de ceux qui ont vomi avaient eu recours à des boissons hypertoniques, 100 % de ceux qui ont vomi avaient mangé dans les 3 heures avant la course et 100 % de ceux qui avaient des maux de ventre avaient mangé des céréales complètes (riches en fibres).
Cette étude clé a mis en avant la problématique de la course en pied. Si ces désagréments arrivent dans toutes activités d’endurance (ski de fond, cyclisme, marche athlétique), elles sont bien plus nombreuses en course à pied du fait des chocs que le corps va subir à chaque appui.
La répercussion de l’onde de choc sur le tractus intestinal en course
En effet, si les troubles digestifs à l’effort touchent l’ensemble des sports d’endurance, ils sont 2 à 3 fois plus fréquents dans la course à pied car l’onde de choc se répercute sur le tube digestif augmentant les phénomènes, notamment la prévalence des diarrhées, ainsi que des saignements digestifs. Ce phénomène sera accentué par la durée de l’effort. Cette cause mécanique est difficile à remédier, car la seule solution consiste à modifier sa technique afin de modérer les pics d’impacts de la force lors de l’appui. Si cette stratégie paraît complexe, car tout changement technique demande un long apprentissage, une seconde est bien plus bénéfique, celle de se ravitailler lors des montées et d’éviter de le faire en haut de la montagne. En effet, les chocs sont beaucoup plus importants lors des descentes et les vibrations qui vont remonter jusqu’aux viscères accentuées.
Le phénomène d’ischémie-reperfusion intestinale
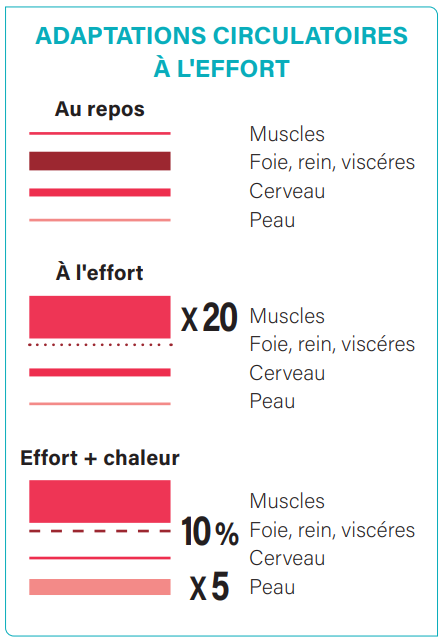
La deuxième cause de ces troubles digestifs à l’effort est due au phénomène d’ischémie-reperfusion intestinale. En effet, lorsque le corps est au repos, la répartition sanguine se fait sur l’ensemble des organes, en priorisant les organes digestifs (foie, rein, viscères).
Les autres organes, comme les muscles ou la peau ont alors une faible irrigation sanguine. L’effort va redéfinir les priorités circulatoires afin d’emmener l’oxygène au muscle via la myoglobine. Le sang va alors irriguer les muscles en multipliant par 20 leur apport et réduisant de manière drastique l’apport intestinal.
En cas de forte chaleur, ce phénomène augmentera car les besoins circulatoires de la peau seront alors multipliés par 5 pour permettre l’évacuation de la sueur et le refroidissement du corps par l’évaporation de cette dernière (Riché, 2012). La sueur sert à éliminer l’excès de chaleur par l’évaporation de la transpiration. Il est d’ailleurs déconseillé d’essuyer la sueur car cela diminue l’efficacité de la transpiration par évaporation.
Ainsi, à 70% de la vitesse maximale aérobie, le flux sanguin intestinal est diminué de 80 %, le sang étant redistribué vers les muscles et la peau pour la régulation thermique.
On parle alors de désertification splanchnique. Les muqueuses intestinales sont alors plus sensibles aux agressions qui ne manqueront pas de se faire dès le début de l’effort : une inflammation des muqueuses va se produire concomitamment à une augmentation du stress oxydatif que nous avons pu détailler dans le précédent article.
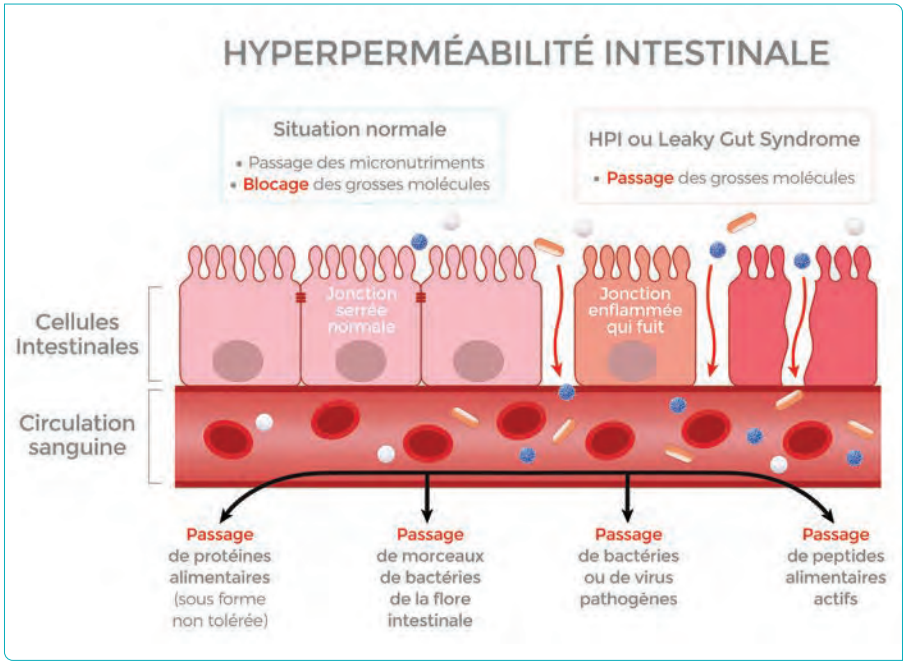
Ce double phénomène va produire de l’hyperperméabilité intestinale ou leaky gut syndromen anglais, qui va laisser alors passer des macromolécules exogènes dans la circulation générale et contribuer à une inflammation généralisée.
Cette perméabilité intestinale est assurée par une protéine, la zonuline, découverte en 2012 par le Dr Fasano (Fasano, 2012) dont le rôle est l’ouverture ou la fermeture des jonctions serrées de l’intestin. Elle joue en quelque sorte le rôle du videur de boîte de nuit en identifiant les micro-organismes pour laisser passer vitamines et autres minéraux dans la circulation générale et en refoulant les indésirables.
Seulement voilà, lors d’une activité d’endurance, le videur de boîte de nuit semble avoir pris ses congés. Il est donc fondamental, d’une part, de ne pas prendre à l’approche de la course des aliments qui peuvent augmenter l’inflammation, comme la célèbre aspirine qui va augmenter les saignements de la muqueuse mise à nu au lieu de contrecarrer cette inflammation et d’autre part, d’éviter « les tueurs de zonuline ».
Pour ce faire, je donne souvent à mes consultants un moyen mnémotechnique de fabrication maison pour les aliments contenant du gluten et emprunté au monde sportif sera de se rappeler si l’on sait jouer « O. B.A.S.K.E.T » : orge, blé, avoine, seigle, kamut, épeautre et triticale. On évitera également la saponine contenue dans les pommes de terre et les anti-inflammatoires non stéroïdiens. On sait également qu’une carence en vitamine D et en zinc contribue à augmenter la perméabilité intestinale.
On veillera alors à avoir un taux optimal de ces micronutriments, ceci d’autant plus que nous avons pu voir qu’une carence en vitamine D peut diminuer le taux de testostérone libre.
La déshydratation
Les déshydratations sont malheureusement fréquentes lors des activités physiques d’endurance. Très souvent non pas par manque d’eau comme on peut l’imaginer, mais au contraire par un trop grand apport d’eau sans minéraux. La perte d’eau s’accompagne de perte de minéraux (sodium et un peu de chlore et de potassium). Pendant un effort, on peut perdre de 1 à 3 litres d’eau par heure.
Il faut compenser avec une boisson d’effort qui compensera les pertes hydriques, glucidiques et minérales (sodium) pour éviter l’hyponatrémie. L’hyponatrémie est un désordre hydro-électrolytique défini par la concentration en sodium (Na) dans le plasma sanguin < 135 mmol/L.
Il en découle une hyperhydratation intracellulaire par effet osmotique : l'eau libre passe du secteur extracellulaire au secteur intracellulaire afin d'égaliser les pressions oncotiques de part et d'autre de la membrane cellulaire. Selon de nombreuses études (Almond et al., 2005 ; Hoffman et al., 2012 ; Kipps et al., 2011), 30 % des athlètes participant à une compétition d’endurance (marathon ou plus) seraient en hyponatrémie à la fin de l’épreuve.
On peut en souffrir, voire en mourir par surhydratation lorsque l’osmolarité devient trop faible en sodium. Les signes cliniques sont variés, parfois retardés et asymptotiques, d’où la complexité de la détection : céphalées, troubles du comportement, vertiges, confusions, fatigue sont quelques-uns de ses signes. Une prise de poids lors d’une compétition peut faire suspecter une hyponatrémie (une prise de 4 % du poids de corps est associée à un risque de 45 % d’être en hyponatrémie, Noakes et al., 2005). Parmi les phénomènes explicatifs avancés, trois en particulier sont retenus :
- L’athlète boit trop et surtout des boissons trop pauvres en sodium (eau, soda, jus de fruit), mais aussi parfois les boissons d’effort isotoniques,
- Perte de sodium par la transpiration très importante sans compensation hydrique adéquate,
- Inadaptation hormonale lorsque la vitesse de déplacement dépasse 60 % de la vitesse aérobie maximale, et une incapacité rénale à éliminer l’eau en excès.
On trouve ce type de risque sur les marathons, les ultras et les triathlons en priorité. Les sujets à risque sont les sportifs lents qui boivent trop (plus de 1,5 l/h) ce qui augmente le déséquilibre électrolytique, les sportifs de faible poids et lorsque les conditions environnementales sont chaudes. Les épreuves ne dépassant pas une heure impliquent peu de risques.‼
Comment faut-il s’hydrater ?
Une légère déshydratation est moins dangereuse qu’une surhydratation, elle ne nuira pas à la performance tant que la perte de poids sera inférieure à 2 %. Tout d’abord, la boisson doit être isotonique ou légèrement hypotonique mais pas hypertonique.
Une boisson isotonique a la même concentration que le sang en minéraux. Elle est facilement absorbée et quitte vite l’estomac. Une boisson hypertonique est trop concentrée et reste dans l’estomac produisant des troubles digestifs et favorisant la déshydratation par appel d’eau de l’estomac pour diluer la concentration.
Une boisson hypotonique est moins bien absorbée qu’une isotonique. Ensuite, la teneur en glucides doit être entre 60 et 80 g/l en choisissant des index glycémiques modérés ou élevés, tout en variant les glucides (glucose, fructose, maltodextrine, saccharose). Cela permet des voies de pénétration différentes et des vitesses d’assimilation variées. Il faut être attentif à ne pas user trop de fructose qui cause des diarrhées.
La teneur en électrolytes doit être comprise entre 500 à 700 mg de sodium par litre (jusqu’à 1 g/l pour les ultras ou en conditions climatiques extrêmes). L’acidification étant source d’inflammation, la boisson doit avoir un PH > 5.5. La saveur impacte sur la consommation. Un goût neutre (maltodextrine) et non écœurant est plus efficace qu’un goût très sucré. La teneur en protéines doit prendre en compte un ratio optimal de 3 g de glucides  pour 1 g de protéines.
pour 1 g de protéines.
On partira donc pour fabriquer sa boisson sur la base d’une eau minérale avec une osmolarité identique à celle du sang (500 mg/L jusqu’à 1 g/L pour les ultras en forte chaleur). La Quézac est dosée à 255 mg/L, l’Arvic à 650 mg/l, la Vichy à 1 172 mg/l et la Saint-Yorre à 1 700 mg/L. On évitera cette dernière trop hypertonique, de même que la Quézac qui est hypotonique, peut être utilisée sur des courses courtes.
Il est tout à fait envisageable de couper une eau hypertonique avec une eau de source faiblement minéralisée pour obtenir la valeur désirée : par exemple, un demi-litre de Vichy coupé avec de l’eau de source arrive à une osmolarité d’environ 550 mg/L. On rajoutera à cette base un peu de miel ou d’agave et de la maltodextrine. On ajoutera enfin 20 g (une demi-dose) d’acides aminés ramifiés par litre (Leucine, Valine et l'Isoleucine), qui permettent d’augmenter la synthèse des protéines et de favoriser la récupération.
Encore mieux, des peptides (ensemble de 2 à 10 acides aminés), une forme hydrolysée des protéines (prédécoupé) sous forme de di-peptides (deux acides aminés) ou tri-peptides (trois acides aminés liés) permet d’optimiser encore plus la récupération et la synthèse protéique (Kanda et al., 2013).
Pour savoir si son hydratation est optimale, deux indicateurs précieux peuvent être utilisés, qu’il faut d’abord tester en entraînement. La première consiste à se peser avant et après l’entraînement, le différentiel ne doit pas dépasser 2 % du poids initial. La deuxième consiste à vérifier la couleur des urines, une couleur claire est témoin d’une bonne dilution, alors que des urines foncées indiquent un manque d’hydratation.
La mauvaise prise alimentaire
Enfin, le dernier point qui contribue aux troubles digestifs à l’effort est la prise alimentaire avant, pendant et après effort. Quelques notions sont à respecter pour diminuer les risques de troubles digestifs à l’effort et éviter les déboires de notre champion de marche.
Avant l’effort, on veillera à respecter un délai de 3 heures entre le dernier repas et l’effort, pour ne pas imposer aux corps un dilemme impossible : envoyer du sang au système digestif et aux muscles en même temps. Le dernier repas devra comprendre peu de lipides (pas de beurre, fromage…) et on veillera à éviter le lactose qui fermentera et risquera de produire des diarrhées.
On diminuera les aliments riches en fibres dans les 24 heures avant (légumes) et on privilégiera une collation de fruits frais (minéralisation et alcalinisation) et d’oléagineux (amandes, noix cajou…). On évitera absolument les anti-inflammatoires ou l’aspirine avant afin de ne pas abîmer la muqueuse intestinale et la faire saigner.
Pendant l’effort, on veillera à s’hydrater dès le départ en version hypotonique à raison de 500 ml/h et à boire à raison de 2-3 gorgées toutes les dix minutes. On favorisera le liquide au solide pour se ravitailler, en combinant apport en protéines (5 g d’acides aminés branchés) et glucides contre la déplétion en glycogène.
Après l’effort, on ne mangera pas immédiatement, pour laisser le temps à l’afflux sanguin de revenir vers le système digestif (minimum 60 minutes), mais on prendra immédiatement à la fin de l’effort un mélange liquide de 30 g de glucides et 10 g de protéine comprenant leucine, isoleucine, valine et glutamine.
La glutamine devra être poursuivie pendant une bonne semaine à raison de 3 g/jour afin de refaire la perméabilité intestinale. Par la suite, on profitera de la fenêtre métabolique propice à la réplétion en glycogène pour prendre environ 50 g de glucides toutes les 2 heures pendant 8 heures. Le repas du soir comprendra des protéines plutôt végétales pour éviter d’augmenter l’acidification qui a été produite par les métabolites issus de l’effort.
Entre les compétitions, on veillera à un équilibre acido-basique et à reconstituer le microbiote grâce aux probiotiques couplés à de la glutamine (gamme PERMEA REGUL® : PERMEA REGUL®, PERMEA REGUL®+ et PERMEA REGUL® FORT).
L’anémie ferriprive du sportif
L’anémie ferriprive du sportif est un phénomène en lien direct avec les troubles digestifs à l’effort et pourtant assez méconnu. Il sera d’autant plus important si le sportif a un niveau initial bas en ferritine.
ll est donc plus marqué chez les végétariens ou flexitariens, et chez les femmes non ménopausées ayant des règles abondantes. Avant de détailler sa physiopathologie, il est nécessaire de rappeler que lors d’un bilan biologique, on ne parle d’anémie ferriprive que lorsque le taux de ferritine est inférieur à 15 ng/ml et le taux d’hémoglobine est inférieur à 120 g/L.
Si le taux d’hémoglobine est normal, on parle de carence martiale. Les signes cliniques d’une carence en fer sont frustes et non spécifiques. De la fatigue, de l’essoufflement anormal à l’effort, une augmentation du rythme cardiaque sont quelques-uns des signes qui peuvent alerter.
Lors de l’effort, différents processus peuvent être amenés à réduire le taux de fer dans l’organisme. Le phénomène d’ischémie-reperfusion est accompagné de microsaignements. La perte sudorale en ambiance chaude et humide peut aller jusqu’à faire perdre 0,08 mg de fer par heure.
Un ultratraileur réalisant l’UTMB en 40 heures peut donc perdre 3 mg de fer par ce simple processus. Les microtraumatismes dus au choc dans la course à pied peuvent également produire une hémorragie intestinale ainsi qu’une hémolyse musculaire et podale.
En effet, les globules rouges vont être fragilisés dans les vaisseaux capillaires sanguins au sein du muscle. Les variations osmotiques et le stress oxydatif intense généré par l’élévation des radicaux libres associées aux hautes contraintes mécaniques dues aux chocs vont rompre ces capillaires, détruire les globules rouges diminuant ainsi le taux de fer circulant.
Cette hémolyse (destruction des globules rouges) au sein des capillaires se produit indépendamment du niveau et de l’intensité de l’effort. On peut la retrouver chez des sportifs amateurs pratiquant des entraînements modérés.
Enfin, comme a pu le faire émerger l’étude de Halvorsen et al. (1 986), une perte sanguine fécale ou urinaire peut augmenter encore le déséquilibre martial.
Il est donc hautement nécessaire de mettre en branle les mécanismes de compensation par l’alimentation. Deux sources de fer proviennent de l’alimentation :
- Le fer héminique, qui provient des globules rouges contenus dans la viande a une biodisponibilité de 25 %. La biodisponibilité désigne la quantité du nutriment qui atteint la circulation sanguine et est disponible pour l'organisme comparé à la quantité ingérée.
- Le fer non héminique d’origine végétale a une biodisponibilité beaucoup plus faible, de l’ordre de 5 % à 10 % et est sous dépendance des associations alimentaires.
Ainsi, la vitamine C augmentera sa biodisponibilité. Inclure des aliments riches en vitamine C comme les fruits (kiwi, orange, citron…) ou les légumes (poivrons, brocolis, persil…) peut augmenter l’assimilation du fer végétal de 2 à 6 fois (Sharma & Mathur, 1995) à condition de ne pas détruire la vitamine C, elle-même très fragile (cuisson, lumière…). A contrario, la caféine ou encore certaines classes de polyphénol la diminuera (Hurrell & Egli, 2010).
On pensera à éviter donc les inhibiteurs de l’absorption du fer non héminique que l’on trouve dans les phytates (céréales complètes, maïs, germes de soja), dans les oxalates (épinards, oseille, rhubarbe, persil, fraises, chocolat noir, patates douces, framboises, betteraves) ou encore les carbonates que l’on trouve dans certaines boissons gazeuses (Vichy célestin, Contrex, Hépar, Vittel).
Seule exception à cette faible biodisponibilité du fer du monde végétal, la spiruline, cette cyanobactérie qui a le vent en poupe qui dispose d’une biodisponibilité de 40 % et d’une quantité de fer de 28 mg pour 100 g.
Mais attention, il est conseillé de prendre environ 5 g de spiruline par jour, ce qui nous conduit à une quantité de fer absorbé aux alentours de 1 mg, bien loin des 15 mg recommandés par jour !
On veillera donc à consommer du fer alimentaire dans les 48 heures post-compétition sous forme de boudin, abats ou spiruline. Les personnes à risque d’anémie ferriprive devront également faire l’objet d’un contrôle sanguin régulier. Une complémentation ne sera nécessaire que quand le taux sera inférieur à 15 ng/ml sous forme de bisglycinate de fer le soir au coucher.
Références :
Almond, C. S. D., Shin, A. Y., Fortescue, E. B., Mannix, R. C., Wypij, D., Binstadt, B. A., Duncan, C. N., Olson, D. P., Salerno, A. E., & Newburger, J. W. (2005). Hyponatremia among runners in the Boston Marathon. New England Journal of Medicine, 352(15), 1550–1556.
Fasano, A. (2012). Intestinal permeability and its regulation by zonulin: diagnostic and therapeutic implications. Clinical Gastroenterology and Hepatology, 10(10), 1096–1100.
Halvorsen, F. A., Lyng, J., & Ritland, S. (1986). Gastrointestinal bleeding in marathon runners. Scandinavian Journal of Gastroenterology, 21(4), 493–497.
Hoffman, M. D., Stuempfle, K. J., Rogers, I. R., Weschler, L. B., & Hew-Butler, T. (2012). Hyponatremia in the 2009 161-km western states endurance run. International Journal of Sports Physiology and Performance, 7(1), 6–10.
Hurrell, R., & Egli, I. (2010). Iron bioavailability and dietary reference values. The American Journal of Clinical Nutrition, 91(5), 1461S-1467S.
Kanda, A., Nakayama, K., Fukasawa, T., Koga, J., Kanegae, M., Kawanaka, K., & Higuchi, M. (2013). Post-exercise whey protein hydrolysate supplementation induces a greater increase in muscle protein synthesis than its constituent amino acid content. British Journal of Nutrition, 110(6), 981–987.
Kipps, C., Sharma, S., & Pedoe, D. T. (2011). The incidence of exercise-associated hyponatraemia in the London marathon. British Journal of Sports Medicine, 45(1), 14–19.
Rehrer, N. J., van Kemenade, M., Meester, W., Brouns, F., & Saris, W. H. M. (1992). Gastrointestinal complaints in relation to dietary intake in triathletes. International Journal of Sport Nutrition and Exercise Metabolism, 2(1), 48–59.
Riché, D. (2012). 20 ans de recherche en micronutrition du sport et de la vie (K-sport).
Sharma, D. C., & Mathur, R. (1995). Correction of anemia and iron deficiency in vegetarians by administration of ascorbic acid. Indian Journal of Physiology and Pharmacology, 39, 403–406.
 |
Cet article a été rédigé par Guillaume LAFFAYE Naturopathe et micronutritionniste Docteur en science |